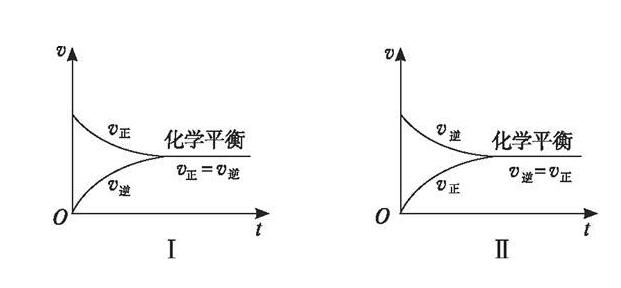
怎么判断化学反应平衡啊
的有关信息介绍如下:一、判断化学平衡状态的本质标志(定义标志)。
1、正逆反应速率相等,也就是v(正)=v(逆)。对于这个标志的使用有注意两点:一是反应速率应有一正一逆,二是正逆反应速率相等。
2、各组分的物质的量浓度保持一定,也就是不再发生改变。
二、判断化学平衡状态的等价标志(衍生标志)。
1、与v(正)=v(逆)等价的标志
(1)从物质的生成速率和消耗速率角度进行判断。对于同一物质,某物质的生成速率等于消耗速率;对于不同物质,速率之比等于化学反应方程式的系数之比,但必须是不同方向的化学反应速率。
(2)从同一时间物质的变化角度进行判断。对于同一物质,同一时间内,生成的物质的量等于消耗的物质的量;对于不同物质,同一时间内,生成的物质的量与消耗的物质的量之比等于化学反应方程式系数之比。
(3)从正逆反应速率的变化角度进行判断。正逆反应速率不再发生改变。
(4)从物质的微观变化角度进行判断。如从单位时间内化学键的变化情况、单位时间内电子得失情况的变化、单位时间内分子的变化情况等等。
2、与各组分的物质的量浓度保持一致等价的标志
(1)从质量角度进行判断。如:各组分质量不再发生变化;反应物总质量或生成物总质量不再发生变化;各组分的质量分数不再发生变化等等。
(2)从物质的量角度进行判断。如各组分物质的带哪量不再发生变化;各组分的物质的量分数不再发生变化;反应物总的物质的量或生成物总的物质的量不再发生变化。
(3)对于有气体参加的反应,且反应前后气体体积发生改变的反应,还可以采用以下特殊的判断标志。如:总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)保持不变。
扩展资料:
化学反应平衡其适用范围是密闭容器中有气体参与或生成的可逆反应。分析压强对化学平衡移动的影响时,要紧抓速率变化与否及是否相等。一般有四种情况:
1、压强改变,浓度改变,并侍速率改变,若V正≠V逆,则平衡移动
对于反应前后气体体积有变化的反应,当其它条件不变时,增大压强,则平衡向气体体积缩小的方向移动;减小压强,平衡向气体体积增大的方向移动。注意:这里的改变压强,即通常所说的由体积变化引起的压强变化。
2、压强改变,浓度改变,速率改变,但V正=V逆,则平衡不移动绝行吵
对于反应前后气体体积不变的反应,其它条件不变时,改变压强,平衡不移动。这里的改变压强,即通常所说的由体积变化引起的压强变化。
3、压强改变,但浓度不变,速率不变,V正=V逆,则平衡不移动
恒温恒容条件下,向已达平衡的可逆反应体系中充入“惰气”,则平衡不移动。注意:这里压强改变,不是通常所说的由体积变化引起。
4、总压强不变,但浓度改变,则速率改变,且V正≠V逆,则平衡移动
对于气体反应体系,保持体系压强不变,向其中充入“惰气”,原来各气体物质的浓度减小,则反应速率减小。此时,判断平衡向哪一方移动,可直接利用压强变化来判断。即相当于减压,平衡向气体体积增大的方向移动。
参考资料来源:百度百科-化学反应平衡